華安(6657)展開多項臨床試驗 喜迎新藥進度開花結果

撰文 / 陳澤樂
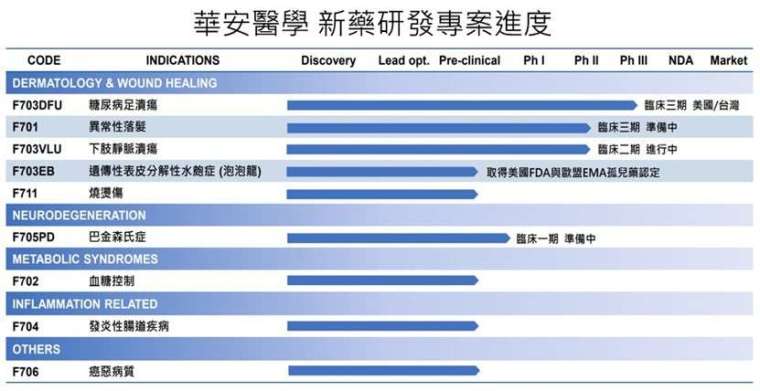
華安醫學 (6657) 近期在證交所舉辦業績說明會,華安表示 F703 糖尿病傷口癒合的外用凝膠在二期臨床試驗顯示 1.5-25 平方公分病患在傷口癒合效果顯著,F703 美國 / 台灣三期臨床預計 2025 年第三季解盲,因此推估 2025 年第一季可以收案完成,預期如果 F703 解盲成功後,華安將立即在台灣申請藥證並在非美國及歐盟地區開始 F703 新藥銷售;接下來華安今年會再展開 F703 第二個三期臨床試驗在歐盟執行,公司預期如果 2027 年第二個三期臨床試驗解盲成功後,將能取得美國及歐盟 F703 藥證,屆時公司可以讓 F703 進行全球藥品銷售。特別是華安屬於小分子藥物,生產成本比其他同業低,因此具備全球銷售的優勢,搶攻超過 100 億美元的糖尿病足部潰瘍藥品市場。
公司今年已準備好申請及執行 F705PD 巴金森氏症口服藥一期臨床試驗,預期很快可以得到一期臨床試驗成果。現今全球的巴金森氏症治療手段,只能延緩疾病進程,但無法完全治癒,華安的 F705PD 是全球第一個可以反轉巴金森氏症的症狀惡化及延緩疾病進程的創新性藥物。德國一流科學研究機構馬克思普朗克研究所曾在 2017 年發現作為細胞能量分子的 ATP 可以作為生物助溶劑 (ydrotrope) 減少異常蛋白質堆積作用。華安期望在今年證實 F705PD 的臨床一期安全性結果後,接下來將執行 F705PD 及 F705AD 阿茲海默症的二期臨床試驗,積極搶攻巴金森氏症及阿茲海默症的全球市場商機。
華安表示,現在除了有明星產品:糖尿病傷口癒合外用凝膠及退化性神經疾病的 F705PD 及 F705AD 外,華安還有 F701 防止異常性落髮外用液劑,F701 在二期臨床試驗結果顯示僅用藥 4 周落髮量即改善 40% 遠優於對照組落建要用藥需要長達 12 周才能改善落髮量 40%,因此華安將在中國申請三期臨床試驗搶攻全球龐大的落髮用藥市場 58 億美元,未來華安更將以全球真空的女性落髮市場作為主要開發市場。
目前華安已經取得美國 FDA 孤兒藥認證 (ODD) 、兒科罕見疾病認證 (RPD) 及 EMA 孤兒藥認證 (ODD) 的 F703EB 遺傳性表皮分解性水皰症 (泡泡龍) 乳膏也準備跟美國 FDA 申請執行二期臨床試驗,由於泡泡龍現行治療以症狀控制為主,而且現行基因療法價格昂貴,華安未來將有機會進軍全球泡泡龍疾病的 24 億美元市場。
值得一提的是近期台灣發生的邦克列酸 (米酵菌酸) 事件造成短時間高致死率,源自於該毒素阻斷細胞能量工廠粒線體的運作,妨礙人體細胞獲得能量,進而導致器官衰竭。由於華安擅長治療粒線體缺失相關疾病,ENERGI 分子可以經由非粒線體途徑,轉換為 ATP 分子提供緊急能量來源,讓華安的 ENERGI 分子受到大家的重視。
華安為因應未來 3 年執行 F703、F705PD、F705AD、F701、F703EB 所需臨床試驗費用已規劃現金增資,然而公司如果與國際藥廠完成新藥授權,除了臨床試驗費用將由國際藥廠負擔也可以取得可觀之授權金,公司將可充足支應未來取得藥證期間的資金需求。
本公司所推薦分析之個別有價證券
無不當之財務利益關係 以往之績效不保證未來獲利
投資人應獨立判斷 審慎評估並自負投資風險